- 各國醫療器械的中央主管機關是?
美國 食品藥品管理局 Food and Drug Administration,簡稱FDA 隸屬於美國衛生教育福利部,負責全國藥品、食品、生物製品、化妝品、獸藥、醫療器械以及診斷用品等的管理。 台灣 衛生福利部食品藥物管理署 Taiwan Food and Drug,簡稱TFDA 隸屬於中華民國衛生福利部,負責食品和藥品的管理監督 歐盟 CE認證 歐盟醫療器材法規 (medical devices regulations, MDR; Regulation (EU) 2017/745)
體外診斷醫療器材法規 (in vitro diagnostic devices regulations, IVDR; Regulation (EU) 2017/746)
- 中國醫療器械的中央主管機關是?
國家藥品監督管理局(National Medical Products Administration,簡稱NMPA)。
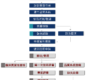
- 中國醫療器械中央主管機構的變遷?
1998年國家醫藥管理局合併了衛生部的藥政局,組建國家藥品監督管理局(SDA)成為國務院直屬。
2003年在國家藥品監督管理局(SDA)基礎上組建國家食品藥品監督管理局(State Food and Drug Administration,簡稱SFDA),國務院直屬。
2013年改為國家食品藥品監督管理總局(China Food and Drug Administration,簡稱CFDA),從衛生部脫離,回歸國務院直屬。
2018年組建國家藥品監督管理局(National Medical Products Administration,簡稱NMPA),由國務院直屬機構國家市場監督管理總局管理。市場監管實行分級管理,藥品監管機構只設到省(一級),藥品經營銷售等行為的監管,由市縣(二級)市場監管部門統一承擔。
- 醫療器械在中國如何分類分級?
2018年8月1日正式實施新版醫療器械分類分級目錄,共分22類 。體外檢驗試劑(IVD)另有獨立專章。
- 關於境內生產,醫療器械質量管理體系的法源依據標準?
要同時符合《醫療器械生產質量管理規範》與YY0287-2017醫療器械 質量管理體系 用於法規的要求/ ISO 13485: 2016。
- 關於境內生產,何謂醫療器械註冊人制度(MAH)?
Marketing Authorization Holder,MAH制度是指將上市許可與生產許可分離的管理模式。NMPA於2019年8月1日正式通知《擴大醫療器械註冊人制度試點工作的通知》(國藥監械注〔2019〕33號),開放北京、天津、河北、遼寧、黑龍江、上海、江蘇、浙江、安徽、福建、山東、河南、湖北、湖南、廣東、廣西、海南、重慶、四川、雲南、陝西省(自治區、直轄市)共21個試點。醫療器械註冊申請人(以下簡稱“申請人”)申請並取得醫療器械註冊證的,成為醫療器械註冊人(以下簡稱“註冊人”)。申請人可以委託具備相應生產能力的企業生產樣品,註冊人可以將已獲證產品委託給具備生產能力的一家或者多家企業生產產品。最大的不同點是,從前醫療器械的註冊與生產是被「捆綁」在一起的,必須由同一個經營主體來完成註冊和生產動作;此制度可視作中國醫療器械的國家政策逐漸與國際接軌(即產證分離)。
- NMPA醫療器械註冊申請規費幣別為人民幣,實施日期為2015/5/27
| 分類 | 首次註冊 | 變更註冊 | 延續註冊 | 臨床試驗審批 | 申請單位 |
| 境外II類 | 210,900 | 42,000 | 40,800 | N/A | NMPA |
| 境外III類 | 308,800 | 50,400 | 40,800 | 43,200 | NMPA |
幣別為人民幣,實施日期為2015/5/27
| 中國境內生產II類器械,各省市收費標準 | |||||
| 省/市 | 首次註冊 | 變更註冊 | 延續註冊 | 實施日期 | 申請單位 |
| 北京市 | 0 | 0 | 0 | 2019.05.01 | 省級、直轄市級藥品監督管理局 |
| 天津市 | 0 | 0 | 0 | 2019.01.01 | |
| 湖北省 | 0 | 0 | 0 | ||
| 重慶市 | 0 | 0 | 0 | 2019.05.15 | |
| 寧夏 | 31,300 | 13,100 | 13,000 | 2017.01.01 | |
| 四川省 | 39,500 | 16,500 | 16,500 | 2017.12.01 | |
| 雲南省 | 42,800 | 17,500 | 17,500 | 2018.04.03 | |
| 貴州省 | 42,900 | 17,600 | 17,600 | 2017.12.22 | |
| 廣東省 | 57,260 | 23,940 | 23,800 | 2019.01.13 | |
| 黑龍江 | 57,600 | 24,160 | 24,000 | 2017.08.01 | |
| 福建省 | 57,700 | 24,200 | 23,900 | 2018.09.20 | |
| 江蘇省 | 59,150 | 24,710 | 24,570 | 2018.12.19 | |
| 浙江省 | 65,730 | 27,510 | 27,300 | 2018.08.01 | |
| 上海市 | 65,730 | 27,510 | 27,300 | 2018.10.01 | |
| 陝西省 | 66,521 | 27,846 | 27,625 | 2017.08.21 | |
| 吉林省 | 68,685 | 28,785 | 28,500 | 2017.08.01 | |
| 安徽省 | 71,500 | 29,900 | 29,700 | 2016.09.05 | |
| 湖南省 | 72,000 | 30,200 | 30,000 | 2017.04.25 | |
| 內蒙古 | 72,100 | 30,200 | 0 | 2016.05.11 | |
| 遼寧省 | 72,200 | 30,200 | 30,000 | 2018.05.01 | |
| 河北省 | 72,300 | 30,300 | 30,000 | 2016.11.11 | |
| 廣西省 | 75,700 | 31,600 | 31,400 | 2017.12.29 | |
| 江西省 | 78,100 | 32,700 | 32,400 | 2015.12.23 | |
| 山東省 | 82,200 | 34,400 | 34,100 | 2016.04.01 | |
| 海南省 | 83,000 | 34,400 | 34,100 | 2016.03.01 | |
幣別為人民幣,實施日期為2015/5/27
| 分類 | 首次註冊 | 變更註冊 | 延續註冊 | 臨床試驗審批 | 申請單位 |
| 國產III類 | 153,600 | 50,400 | 40,800 | 43,200 | NMPA |
- 互貴興業扮演的角色
醫療器械委託生產製造,即CMO(OEM)、CDMO(ODM)